化学方程式的读法及表示的含义、化学方程式的读法及表示的含义视频讲解
一.化学方程式的书写原则
1.必须以客观事实为依据,不能凭空臆造事实上不存在的物质和化学反应。
2.遵守质量守恒定律,使等号两边原子的种类和数目必须相等。
二.化学方程式的书写步骤
书写化学方程式要按一定步骤进行,避免出现一些不必要的错误,如漏掉反应条件和“↑”“↓”等。书写化学方程
式的一般步骤可概括为:“一写,二配,三注”(见课本范例)
1.写:根据事实写出反应物和生成物的化学式(左反、右生),并在反应物和生成物之间画一条短线。
2.配:配平化学方程式的目的是使等号两边的原子种类与数目相等,遵守质量守恒定律,配平后要加以检查。
3.注:注明化学反应发生的条件(点燃、加热等),标出生成物状态(气体,沉淀等),把短线改成等号。
三.书写化学方程式时的注意事项
1.化学反应的常见条件有“点燃”、“加热”(常用“△”表示)“高温”,“催化剂”等,写在等号上方;
2.如果反应物没有气体而生成物中有气体,在气体物质的化学式右边要注“↑”;
3.溶液中的反应如果生成物是固体,在固体物质化学式右边注“↓”。
四.书写化学方程式的口诀
左写反应物,右写生成物;写准化学式,系数(化学计量数)要配平;中间连等号,条件要注明;生成气体和沉淀,
要用“↑”“↓”来标明。
五.配平化学方程式的常用方法
化学变化过程中,必然遵循质量守恒定律,即反应前后:宏观方面元素种类、质量不变,微观方面原子种类、数目、质量不变。
配平化学方程式就是在化学式前面配上适当的化学计量数(系数)使式子左、右两边的每一种元素的原子数目相等。
而不是通过改变化学式中元素符号右下角的数字使式子左、右两边的每一种元素的原子数目相等,这样就改变了物质的构成,违背了第一条原则,即违背客观事实。
常用的配平化学方程式的方法有:
(1)最小公倍数法:一般用于配平较为简单的化学反应的化学方程式
在配平化学方程式时,观察反应前后各出现一次且个数相差最多的原子,作为配平起点先进行配平.先计算出反应前后该元素原子的最小公倍数,用改变化学式前面化学计量数的方法,对该原子进行配平,然后观察配平其他元素的原子个数,使化学反应中反应物与生成物的元素种类与原子个数都相同。
例如:教材介绍的配平方法,就是最小公倍数法.在P+O2――P2O5反应中先配氧:最小公倍数为10,得O2化学计量数为
5与P2O5的化学计量数为2,P+5O2――2P2O5;再配平磷原子,4P+5O2==2P2O5。
尝试练习Al+O2――Al2O3;
KClO3――KCl+O2
Fe2O3+C――Fe+CO2.
(2)奇数变偶数法:
选择反应前后出现次数多且化学式中原子个数为一奇一偶的元素的原子作配平起点,在含有奇数个该原子的化学式前先加最小的偶数2(若2不行,也可能是4、6、8等,不能加奇数),将该原子数由奇数变成偶数,然后再配平其他元素原子的方法称为奇数变偶数法。
例如:甲烷(CH4)燃烧方程式的配平,就可以采用奇数变偶数法:CH4+O2――H2O+CO2,反应前O2中氧原子为偶数,而反应后H2O中氧原子个数为奇数,先将H2O前配以2将氧原子个数由奇数变为偶数:CH4+O2――2H2O+CO2,再配平其他元素的原子:
CH4+2O2=2H2O+CO2.
尝试练习:
FeS2+O2――Fe2O3+SO2,
Fe2O3+C――Fe+CO2.
(3)设(定)一法:
找到化学方程式中关键的化学式,设其化学式前计量数为1,然后根据关键化学式去配平其他化学式前的化学计量数.
若出现计量数为分数,再将各计量数同乘以同一整数,化分数为整数,这种先定关键化学式计量数为1的配平方法,称为设一法。
例如:甲醇(CH3OH)燃烧化学方程式配平可采用此法:CH3OH+O2――H2O+CO2,显然决定生成H2O与CO2的多少的关键是甲醇的组成,因而定其计量数为1,这样可得其燃烧后生成H2O与CO2的分子个数:CH3OH+O2――2H2O+CO2.然后配平氧原子:CH3OH+3/2O2=2H2O+CO2,将各计量数同乘以2化分为整数:2CH3OH+3O2=4H2O+2CO2。
尝试乙醇的燃烧其化学方程式的配平C2H5OH+O2――H2O+CO2
(4)观察法:
当反应方程式两边有的物质组成较为复杂时,通过对某物质的化学式分析,找出规律来判断配平时化学计量数的方法。
例如:配平Fe2O3+CO――Fe+CO2.在反应中,每一个CO结合一个氧原子生成CO2分子,而Fe2O3则一次性提供三个氧原
子,因而必须由三个CO分子来接受这三个氧原子,生成三个CO2分子即
Fe2O3+3CO――Fe+3CO2
,最后配平方程式
Fe2O3+3CO=2Fe+3CO2,这种配平方法是通过观察分析Fe2O3化学式中的氧原子个数来决定CO的化学计量数的,故称为观察法。
法无定法。最小公倍数法是基础,其他方法离不开该法,因此要掌握该法。
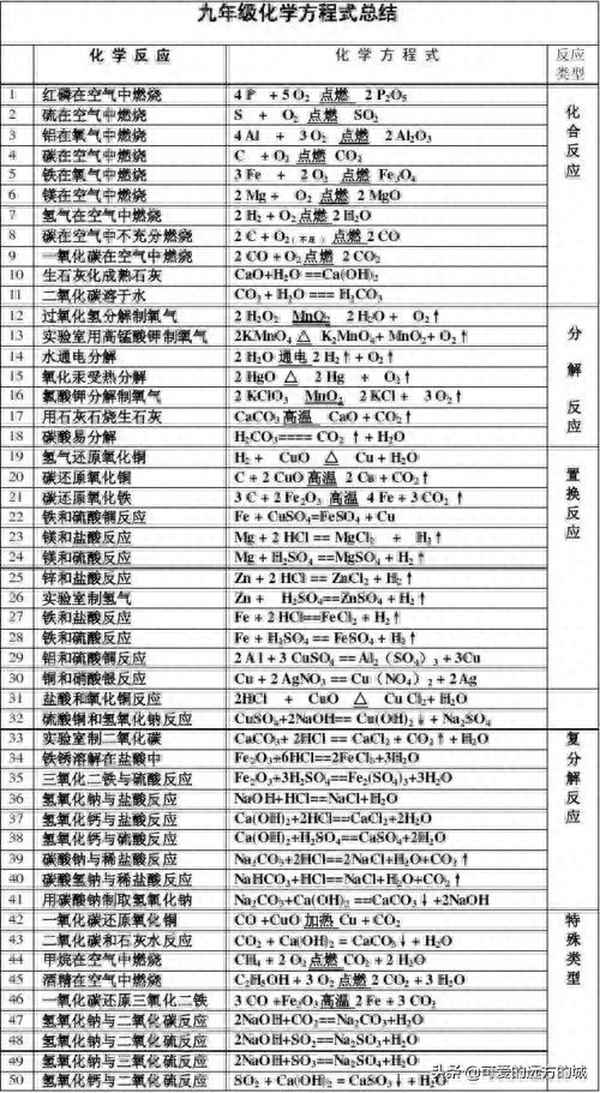
初中常见化学反应方程式